Perbedaan antara reaksi kombinasi dan dekomposisi | Reaksi Kombinasi vs Dekomposisi
Perbedaan Kunci - Reaksi Kombinasi vs Dekomposisi Reaksi kimia adalah konversi satu atau lebih senyawa kimia menjadi satu atau lebih produk yang berbeda, mengubah identitas senyawa kimia. Bahan awal reaksi kimia disebut reaktan dan senyawa yang dihasilkan disebut produk. Perincian senyawa atau kombinasi senyawa dan pembentukan senyawa baru akan terjadi selama proses reaksi kimia karena ikatan antara atom senyawa rusak dan tercipta dengan cara yang berbeda. Reaksi kimia dapat dibagi menjadi beberapa kategori besar. Reaksi redoks atau reaksi reduksi oksidasi sangat penting di antara mereka. Reaksi oksidasi dan reduksi disebut reaksi transfer elektron karena elektron reaktan dipindahkan dari satu senyawa ke senyawa lainnya ke yang lain untuk menyebabkan reaksi. Dalam reaksi redoks, dua reaksi paralel, yang disebut setengah reaksi, terjadi pada saat bersamaan. Reaksi setengah ini menunjukkan transfer elektron. Dengan menyeimbangkan setengah reaksi ini, orang bisa menebak keseluruhan reaksi yang telah terjadi pada akhirnya. Reaksi kombinasi dan reaksi dekomposisi adalah dua jenis utama reaksi redoks. Perbedaan utama antara reaksi kombinasi dan dekomposisi adalah bahwa kombinasi reaksi
melibatkan kombinasi reaktan untuk menghasilkan reaksi dekomposisi produk tunggal sedangkan melibatkan pemecahan senyawa tunggal menjadi dua atau lebih produk.
DAFTAR ISI1. Ikhtisar dan Perbedaan Kunci
2. Apa itu Reaksi Kombinasi
3. Apa itu Reaksi Dekomposisi
4. Perbandingan Side by Side - Reaksi Kombinasi vs Dekomposisi
5. Ringkasan
Apa itu Reaksi Kombinasi?
Reaksi kombinasi, juga disebut reaksi sintesis
, adalah reaksi dimana senyawa reaktan digabungkan untuk membentuk senyawa yang berbeda sebagai produk. Dengan kata lain, reaksi molekul sederhana menghasilkan molekul kompleks. Beberapa atau semua ikatan antara atom dari senyawa tertentu dipecah; Pada saat yang sama, atom akan bergabung membentuk senyawa baru, yang merupakan produknya. Dalam reaksi dekomposisi, reaktan yang sama bertindak sebagai bahan awal untuk kedua reaksi setengah.Tidak seperti reaksi dekomposisi, reaksi setengah reaksi kombinasi memiliki reaktan yang berbeda. Hasil reaksi kombinasi dalam satu produk. Berikut ini adalah contoh umum yang bisa diberikan sebagai reaksi pembakaran.
2 ), terjadi reaksi gabungan dan menghasilkan Aluminium bromida (AlBr 3 ). Di sini, bilangan oksidasi meningkat di Al dan menurun dalam Br. Oleh karena itu, ini adalah reaksi redoks dan merupakan reaksi kombinasi karena dua reaktan bereaksi untuk memberikan satu produk tertentu. Gambar 01: Reaksi Kombinasi
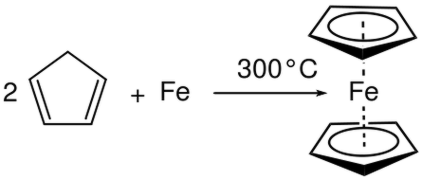
Reaksi dekomposisi merupakan reaksi penting lainnya dalam kategori reaksi redoks. Hal ini pada dasarnya berlawanan dengan reaksi kombinasi. Reaksi dekomposisi adalah reaksi dimana senyawa reaktan dipecah menjadi produk. Di sini, setengah reaksi terjadi bersamaan dengan reaksi oksidasi dan reaksi reduksi. Tapi tidak seperti reaksi kombinasi, reaktan untuk kedua reaksi setengah sama dalam reaksi dekomposisi. Reaksi dekomposisi menghasilkan beberapa produk.
Dalam elektrolisis air, bila arus searah dilewatkan melalui air, molekul air terdekomposisi untuk memberi oksigen dan gas hidrogen. Di sini, bilangan oksidasi meningkat dalam atom oksigen dan mengalami penurunan dalam atom hidrogen. Oleh karena itu, ini adalah reaksi redoks dan reaksi dekomposisi karena pemecahan molekul air menjadi gas oksigen dan hidrogen.
Gambar 02: Kombinasi vs Dekomposisi

Apa perbedaan antara Reaksi Kombinasi dan Dekomposisi?
- diff Article Middle before Table ->
Reaksi Kombinasi vs Dekomposisi
Dua atau lebih senyawa reaktan dilibatkan dalam reaksi kombinasi. |
|
| Senyawa tunggal terlibat dalam reaksi dekomposisi. | Produk |
| Hasil reaksi kombinasi dalam satu produk. | |
| Reaksi dekomposisi menghasilkan beberapa produk. | Reaksi Setengah |
| Dalam reaksi gabungan, dua reaksi setengah memiliki dua molekul awal yang berbeda. | |
| Dalam reaksi dekomposisi, molekul tunggal bertindak sebagai bahan awal untuk kedua reaksi setengah. | Obligasi Kimia |
| Reaksi gabungan menghasilkan ikatan atom untuk menghasilkan produk akhir tunggal. | |
| Dalam reaksi dekomposisi, ikatan kimia dipecah menjadi dua atau lebih produk akhir. | Molekul |
| Reaksi kombinasi menyebabkan molekul sederhana bereaksi dan menghasilkan molekul kompleks. | |
| Reaksi dekomposisi menyebabkan molekul kompleks terurai menjadi molekul sederhana. | Ringkasan - Reaksi Kombinasi vs Dekomposisi |
Reaksi redoks sangat banyak merupakan bagian dari dunia di sekitar kita karena sebagian besar reaksi kimia penting adalah reaksi redoks. Reaksi kombinasi dan reaksi dekomposisi adalah reaksi sederhana yang berlawanan satu sama lain. Perbedaan utama antara reaksi kombinasi dan dekomposisi adalah bahwa reaksi kombinasi melibatkan kombinasi dua atau lebih molekul reaktan untuk menghasilkan satu produk akhir sedangkan reaksi dekomposisi melibatkan pemecahan molekul tunggal menjadi dua atau lebih produk.
Referensi:
1. Chang, R., 2010. kimia. 10 ed. NewYork: McGraw-Hill.
2. Redoks. (2009, 30 Juli). Diakses pada tanggal 29 Mei 2017, dari // weakinteractions. wordpress com / primer / redox /
3. Reaksi. (n. d.). Diakses pada 29 Mei 2017, dari // www. ric. edu / fakultas / ptiskus / reaksi /
Gambar Courtesy:
1. "Miller Ferrocen Synthese" Oleh Bert. Kilanowski - Karya sendiri (CC0) melalui Commons Wikimedia
2. "Reaksi kimia" Oleh Daniele Pugliesi - Memiliki pekerjaan (CC BY-SA 3. 0) melalui Commons Wikimedia [Cropped]




