Perbedaan antara monatomik dan diatomik | Monatomic vs Diatomic
Perbedaan antara monatomik dan diatomik terutama berkaitan dengan atom yang ada pada spesies ini. Seperti namanya, kedua istilah ini berdiri untuk berbagai keadaan asosiasi atom di mana 'mono' berarti 'satu' dan 'di' berarti 'dua. 'Oleh karena itu, secara sederhana, monatomik berarti satu'
satu atom 'dan diatomik berarti' dua atom. ' Namun, bisa jadi ada banyak variasi yang berbeda dengan definisi dasar ini.
Apa itu Monatomik?Bila
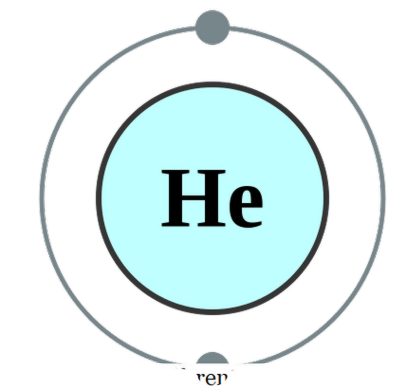
sebuah atom tunggal ada pada dirinya sendiri (yang jarang terjadi), kita menyebutnya monatomik. Ini berarti unsur-unsur itu dalam bentuk tunggal murni mereka. Satu-satunya contoh praktis yang mungkin masuk kategori ini adalah gas mulia yang ada seperti atom sendiri karena memiliki kulit terluar yang dilengkapi dengan oktet elektron. Oleh karena itu, mereka tidak melihat untuk menerima atau menyumbangkan lebih banyak elektron agar lebih stabil. Oleh karena itu, gas mulia stabil dalam bentuk monatomik. Beberapa contohnya adalah; Dia - Helium, Ne - Neon, Ar - Argon, Xe - Xenon, Kr - Krypton, Rn - Radon.
Apa itu Diatomi?
Ketika
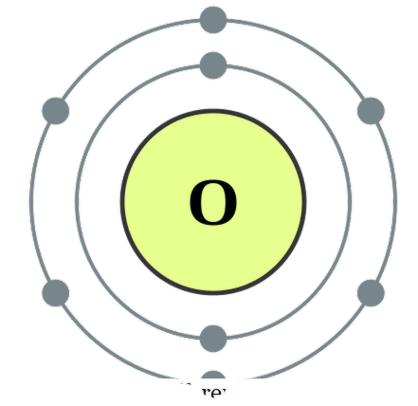
dua atom saling terkait , kita menyebutnya diatomik. Atom ini bisa dari jenis yang sama atau berbeda. Ketika mereka adalah dua atom yang sama dalam hubungan kita menyebutnya ' diatom homonuklir ' dan jika mereka dibuat dari jenis yang berbeda, kita menyebutnya 'diatom heteronuklir '. Contoh untuk beberapa dionom homonuklir adalah O2, N2, H2, dll sedangkan CO, NO, HCl, dll dapat diberikan sebagai contoh untuk diatom heteronuklir. Oksigen Diatom dapat dianggap sebagai senyawa saat mereka membentuk asosiasi ini untuk mencapai stabilitas lebih dengan berbagi elektron satu sama lain sehingga kedua atom tersebut mencapai konfigurasi elektronik gas mulia. Mereka dapat ikatan melalui ikatan kovalen oleh tumpang tindih orbital atom atau mereka dapat membentuk ikatan ionik di antara mereka yang merupakan daya tarik antara spesies bermuatan positif dan spesies yang bermuatan negatif. Contoh untuk ikatan kovalen antara diatom meliputi CO, NO, dll dan HCl dapat dianggap sebagai spesies dengan karakter tarik ionik. Namun, karena kekuatan tarik antara H + dan Cl - tidak terlalu kuat, ini bukan contoh bagus untuk ikatan ionik yang merupakan topik lain yang pasti.
Apa perbedaan antara Monatomik dan Diatomi?
• Spesies monatomik memiliki satu atom sedangkan spesies diatomik memiliki dua atom.
• Spesies monatomik umumnya tidak stabil, namun spesies diatomik pada umumnya stabil.
• Gas mulia hanya monatom dan tidak ditemukan dalam bentuk diatomik.
• Ada ikatan kimia antara spesies diatomik sedangkan tidak ada ikatan pada spesies monatomik.
Gambar Courtesy:
Konfigurasi elektron Helium oleh Pumbaa (CC BY-SA 2. 0 uk)
Konfigurasi elektron oksigen oleh DePiep (CC BY-SA 3. 0)


