Perbedaan antara orbit 1s dan 2s | 1s vs 2s Orbital
Perbedaan Kunci - 1s vs 2s Orbital
Atom adalah satuan materi terkecil. Dengan kata lain, semua materi terbuat dari atom. Sebuah atom terdiri dari partikel subatomik, terutama, proton, elektron, dan neutron. Proton dan elektron membuat nukleus, yang terletak di pusat atom. Tapi elektron diposisikan dalam orbital (atau tingkat energi) yang berada di luar inti atom. Penting juga untuk dicatat bahwa orbital adalah konsep hipotetis yang digunakan untuk menjelaskan lokasi atom yang paling mungkin terjadi. Ada berbagai orbital yang mengelilingi nukleus. Ada juga sub-orbital seperti s, p, d, f, dan lain-lain. S-orbital s berbentuk bulat bila dianggap sebagai struktur 3D. Orbital s memiliki probabilitas tertinggi untuk menemukan elektron di sekitar nukleus. Sebuah sub-orbital sekali lagi diberi nomor sebagai 1s, 2s, 3s, dll sesuai dengan tingkat energi. Perbedaan utama antara orbital 1s dan 2s adalah energi setiap orbital. Orbital orbital memiliki energi yang lebih rendah daripada orbital 2s.
DAFTAR ISI
1. Ikhtisar dan Perbedaan Kunci
2. Apa itu orbit Orbital
3. Apa itu Orbital 2s
4. Side by Side Perbandingan - 1s vs 2s Orbital
5. Ringkasan
Apa itu Orbital? Orbital orbital
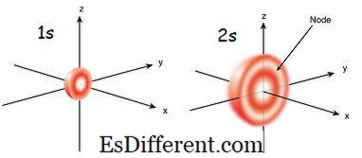
adalah orbital yang paling dekat dengan nukleus. Ini memiliki energi terendah di antara orbital lainnya. Ini juga bentuk bola terkecil. Oleh karena itu, jari-jari orbital s kecil. Hanya ada 2 elektron di orbital s. Konfigurasi elektron dapat ditulis sebagai 1s 1 , jika hanya ada satu elektron di orbital s. Tetapi jika ada sepasang elektron, itu bisa ditulis sebagai 1s 2 . Kemudian kedua elektron di orbital s bergerak ke arah yang berlawanan karena adanya tolakan yang terjadi karena muatan listrik yang sama dari dua elektron. Bila ada elektron yang tidak berpasangan, itu disebut paramagnetik. Itu karena bisa ditarik oleh magnet. Tetapi jika orbital terisi dan sepasang elektron hadir, elektron tidak dapat ditarik oleh magnet; ini dikenal sebagai diamagnetic.
Apa itu Orbital 2s? Orbital 2s lebih besar dari orbital 1s. Oleh karena itu, radiusnya lebih besar dari orbital 1s. Ini adalah orbit orbital berikutnya ke nukleus setelah orbital 1s. Energinya lebih tinggi dari orbital 1s tetapi lebih rendah dari orbital lain dalam sebuah atom. Orbital 2s juga bisa diisi hanya dengan satu atau dua elektron. Tapi orbital 2s diisi dengan elektron hanya setelah selesainya orbital 1s.Ini disebut prinsip Aufbau, yang mengindikasikan urutan pengisian elektron ke sub-orbital.
Apa perbedaan antara Orbital 1s dan 2s?
- diff Article Middle before Table ->
1s vs 2s orbital orbital orbital 1s adalah orbital terdekat ke nukleus. Orbital orbital orbital
adalah orbit kedua terdekat ke nukleus. |
|
| Tingkat Energi | Energi orbital 1s lebih tinggi dari orbital 2s. |
| 2s memiliki energi yang relatif lebih rendah. Radius Orbital | |
| Jari-jari orbital 1s lebih kecil. | Jari-jari orbital 2s relatif besar. Orbital |
| orbital 1 memiliki bentuk bola terkecil. Orbital | |
| 2s lebih besar dari orbital 1s. | Pengisian Elektron |
| Elektron diisi pertama kali dalam orbital 1s. Orbital | |
| 2s diisi hanya setelah selesainya elektron di orbital 1s. | Ringkasan - 1s vs 2s Orbital |
| Atom adalah struktur 3D yang mengandung nukleus di pusat yang dikelilingi orbital berbentuk berbagai tingkat energi yang berbeda. Orbital ini lagi-lagi dibagi menjadi sub-orbital sesuai dengan sedikit perbedaan energi. Elektron, yang merupakan partikel subatomik utama atom terletak di tingkat energi ini. Subbagian orbital 1s dan 2s paling dekat dengan nukleus. Perbedaan utama antara orbital 1s dan 2s adalah perbedaan tingkat energinya, yaitu orbital 2s adalah tingkat energi yang lebih tinggi dari orbital 1s. | |
| Referensi: | 1. Libretexts "Orbit atom. "LibreTexts Kimia. Libretexts, 03 November 2015. Web. 26 Mei 2017.. |
2. Atom, Elektron dan Orbitals. N. hal., n. d. Web. 26 Mei 2017..
Gambar Courtesy:
1. "S orbital" (dipotong) Oleh Yayasan CK-12 - Berkas: Kimia Sekolah Tinggi. pdf, halaman 265 (CC BY-SA 3. 0) melalui Commons Wikimedia