Perbedaan Antara Titrasi Asam Basa dan Titrasi Redoks | Titrasi Asam Basa vs Titrasi Redoks
Perbedaan Kunci - Titrasi Asam Basa vs Titrasi Redoks
Secara umum, titrasi digunakan untuk menentukan konsentrasi larutan yang tidak diketahui (analit). Dua metode titrimetrik yang paling umum digunakan adalah titrasi asam basa dan titrasi redoks. Perbedaan antara titrasi asam basa dan titrasi redoks adalah sifat reaksi yang terjadi antara titran dan analit dalam titrasi. Dalam titrasi asam basa, reaksi netralisasi terjadi dan dalam titrasi redoks, reaksi redoks berlangsung (reaksi pengoksidasi dan reaksi reduksi). Penggunaan indikator adalah metode yang paling umum digunakan untuk menentukan titik akhir reaksi.
Apa itu Titrasi Asam Basa?
Dalam titrasi asam basa, asam (titrasi asam) atau basa (titrasi dasar) digunakan sebagai titran. Contoh asam yang digunakan dalam titrasi asam adalah H 2 SO 4 , HCl, atau HNO 3. Sebagian besar menggunakan titran dasar adalah NaOH, K 2 CO 3 atau Na 2 CO 3. Titrasi asam-basa dapat diklasifikasikan sebagai berikut tergantung pada kekuatan asam dan basa.
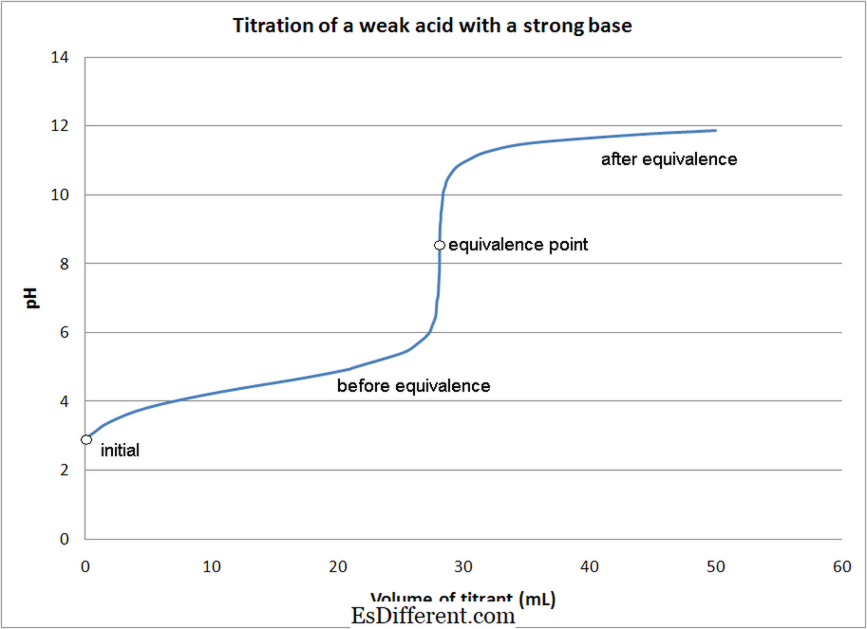
Asam lemah - titrasi dasar yang kuat- Titrasi dasar asam kuat lemah
- Asam lemah - titrasi dasar yang kuat
- Asam lemah - titrasi dasar yang lemah
- Pada sebagian besar asam - titrasi basis, indikator digunakan untuk menentukan titik akhir reaksi. Indikator yang berbeda digunakan tergantung pada jenis titrasi seperti yang disebutkan di atas.
Titrasi redoks melibatkan reaksi redoks. Reaksi redoks memiliki dua reaksi; reaksi oksidasi dan reaksi reduksi. Proses oksidasi dan reduksi berlangsung pada saat bersamaan dimana memungkinkan kita untuk menentukan selesainya reaksinya. Ini juga dikenal sebagai titik akhir titrasi. Hal ini dapat ditentukan dengan beberapa cara; menggunakan indikator elektroda, indikator redoks (indikator menghasilkan warna yang berbeda pada keadaan reduksi oksidasi), dan indikator non-redoks (indikator menghasilkan warna bila jumlah titran berlebih ditambahkan).
Apa perbedaan antara Titrasi Asam-Basa dan Titrasi Redoks?

Sifat reaksi:
Titrasi Asam Basa:
Titrasi asam-basa melibatkan reaksi netralisasi antara analit (larutan dengan konsentrasi yang tidak diketahui) dan titran asam atau dasar. Redoks Titrasi:
Reaksi redoks melibatkan reaksi oksidasi dan reduksi antara analit dan titran. Tidak ada aturan seperti itu bahwa komponen mengoksidasi dan mana yang mengurangi. Entah analit atau titrasi oksidasi, dan komponen sisanya akan berkurang. Penentuan titik akhir:
Titrasi Asam Basa:
Secara umum, indikator pH, meter pH atau meteran konduktansi digunakan untuk menentukan titik akhir titrasi asam-basa. Titrasi Redoks:
Metode yang paling umum digunakan untuk menentukan titik akhir reaksi redoks menggunakan indikator potensiometer atau redoks. Tapi, yang paling sering adalah analit atau titran menghasilkan warna pada titik akhir. Sehingga, indikator tambahan tidak diperlukan dalam kasus tersebut. Contoh:
Titrasi Asam Basa:
- diff Article Middle before Table ->
Tipe| Reaksi (Indikator) | Asam kuat - titrasi basa kuat |
| HCl + NaOHàNaCl + H | 2 O (Fenolftalein / Metil jeruk) Asam kuat - titrasi dasar lemah |
| HCl + NH | 3 NH 3 Cl (Methyl orange) Asam lemah - titrasi dasar yang kuat |
| CH | 3 COOH + NaOHà CH 3 COONa + H 2 O (Phenolphthalein) Titrasi asam lemah-asam dasar |
| CH | 3 COOH + NH 3 àCH 3 COO - + NH 4 + (Tidak ada indikator yang sesuai) Titrasi Redoks: |
2 KMnO
4 + 5 H 2 C 2 O 4 + 6 HCl → 2 MnCl 2 + 2KCl + 10 CO 2 + 8 H 2 O (+ 7) (+3) (+2) (+ 4) Pada reaksi di atas, permanganat dikurangi sementara asam oksalat dioksidasi. Saat reaksi selesai, warna ungu permanganat berubah menjadi tidak berwarna.
KMnO
4
+ 5FeCl 2 + 8HCl → 5FeCl 3 + MnCl 2 + KCl + 4H 2 O (+ 7) (+2) (+3) (+2) Gambar Courtesy:
1. Titrasi asam lemah dengan dasar kuat Oleh Quantumkinetics (Kerja Sendiri) [CC BY 3. 0], via Wikimedia Commons
2. "Titrasi Titrasi Winkler Sebelum" oleh Willwood [CC BY-SA 3. 0] via Commons




