Perbedaan antara Berilium dan Aluminium | Beryllium vs Aluminium
adalah bahwa Berilium adalah molekul dalam kelompok II (nomor atom = 4) sedangkan Aluminium adalah unsur kelompok XIII (nomor atom = 13). Mereka memiliki sifat kimia yang berbeda, dan unik untuknya. Misalnya, jika kita mempertimbangkan sifat logamnya, Berilium adalah logam paling ringan yang digunakan dalam konstruksi dan Aluminium adalah logam terbesar kedua yang digunakan di dunia setelah Besi. Beryllium Beryllium Apa itu Berilium? ?
Berilium (Be) adalah unsur kimia dengan a nomor tomik 4, dan konfigurasi elektroniknya adalah 1s2
2s 2 . Ini ada di kelompok II dan periode 2 di tabel periodik. Ini adalah anggota keluarga alkali tanah yang paling ringan. Berilium secara alami terjadi dengan unsur-unsur lain seperti Bertrandite (Be 4 Si 2 O 7 (OH) 2 ), Beryl (Al < 2 Jadilah 3 Si 6 O 18 ), Chrysoberyl (Al 2 BeO 4 ) dan Phenakite (Be 2 SiO 4 ). Kelimpahan berilium di permukaan bumi sekitar 4-6 ppm, relatif rendah.

2s
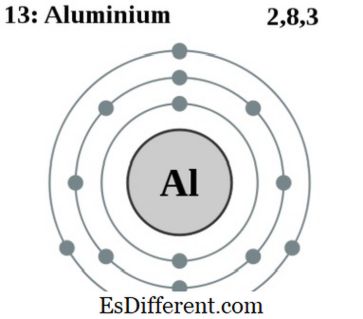
2 2p 6 3s 2 3p 1 . Hanya ada satu isotop aluminium-27. Secara alami terjadi banyak mineral dan kelimpahan aluminium di kerak bumi. Aluminium merupakan elemen yang sangat penting dalam aplikasi industri. Ini adalah elemen logam terbesar kedua yang digunakan di dunia.
Berilium adalah unsur logam dengan permukaan putih keabu-abuan; itu rapuh dan keras (kepadatan = 1. 8 gcm
-3
). Ini adalah elemen metalik paling ringan yang bisa digunakan dalam industri konstruksi. Titik lebur dan titik didihnya masing-masing adalah 1287 ° C (2349 ° F) dan 2500 ° C (4500 ° F). Berilium memiliki kapasitas panas yang tinggi dan konduktivitas panas yang baik. Berilium memiliki properti menarik terkait penetrasi sinar-x melalui material. Ini transparan untuk sinar-x; Dengan kata lain, sinar-x bisa melewati Berilium tanpa diserap. Untuk alasan ini, terkadang digunakan untuk membuat jendela di mesin sinar-x.Aluminium Aluminium memiliki kilau logam perak dengan warna sedikit kebiru-biruan. Ini adalah kedua ulet (kemampuan untuk membuat menjadi kawat tipis) dan lunak (kemampuan untuk palu atau tekan secara permanen keluar dari bentuk tanpa pecah atau retak). Titik leburnya adalah 660 ° C (1220 ° F), dan titik didihnya adalah 2327-2450 ° C (4221-4442 ° F). Kepadatan Aluminium adalah 2. 708gcm -3
. Aluminium adalah konduktor elektrik yang sangat bagus. Ini adalah bahan berbiaya rendah, dan insinyur mencoba menggunakan Aluminium lebih sering di peralatan listrik.
Sifat Kimia: Berilium: Berilium bereaksi dengan asam dan air yang menghasilkan gas hidrogen. Ini bereaksi dengan oksigen di udara dan membentuk lapisan oksida pelindung di permukaan dan mencegah logam bereaksi lebih jauh. Aluminium: Aluminium perlahan bereaksi dengan oksigen dan membentuk lapisan tipis yang sangat tipis pada logam. Lapisan oksida ini mencegah oksidasi logam lebih lanjut dan berkarat. Aluminium cukup reaktif; itu bereaksi dengan asam panas dan dengan alkali juga. Untuk alasan ini, Aluminium dianggap sebagai unsur amfoter (bereaksi dengan asam dan alkali). Selain itu, ia bereaksi cepat dengan air panas dan bentuk bubuk Aluminium dengan cepat menangkap api saat terkena nyala api.
Kegunaan:
Berilium: Berilium banyak digunakan dalam paduan; paling populer dengan tembaga. Hal ini juga digunakan dalam pembuatan peralatan telekomunikasi, komputer, dan telepon seluler. Aluminium
Aluminium digunakan untuk memproduksi bahan kemasan, peralatan listrik, mesin, mobil dan industri konstruksi. Ini juga digunakan sebagai foil dalam kemasan; ini bisa dicairkan dan digunakan ulang atau didaur ulang. Gambar Courtesy:
1. Kerang elektron 004 Berilium - tidak ada label Oleh Pumbaa (karya asli oleh Greg Robson)
(Berkas: Elektron shell 004 Beryllium. Svg) [CC BY-SA 2. 0 uk], melalui Wikimedia Commons
2. Elektron shell 013 Aluminium Dengan karya turunan Pumbaa: Materialcientist [CC BY-SA 2. 0 uk], melalui Wikimedia Commons