Perbedaan antara senyawa ionik dan kovalen | Senyawa Ionic vs Covalent
Perbedaan Kunci - Senyawa Ionic vs Covalent
Banyak perbedaan dapat dicatat antara senyawa ionik dan kovalen berdasarkan sifat makroskopisnya seperti kelarutan dalam air, konduktivitas listrik, titik leleh dan titik didih. Alasan utama perbedaan ini adalah perbedaan dalam pola ikatan mereka. Oleh karena itu, pola ikatan dapat dianggap sebagai kunci perbedaan antara senyawa ionik dan kovalen. (Perbedaan Antara Ionik dan Kovalen) Ketika ikatan ion terbentuk, elektron yang disumbangkan oleh logam dan elektron yang disumbangkan diterima oleh logam bukan logam. Mereka membentuk ikatan yang kuat karena atraksi elektrostatik. Ikatan kovalen terbentuk antara dua non-logam. Dalam ikatan kovalen, dua atau lebih atom berbagi elektron untuk memenuhi aturan oktet. Umumnya ikatan ion lebih kuat dari pada ikatan kovalen. Hal ini menyebabkan perbedaan sifat fisiknya.
Apa itu Senyawa ionik?
Ionik ikatan terbentuk ketika dua atom memiliki perbedaan besar dalam nilai elektronegativitasnya. Dalam proses pembentukan ikatan, atom yang kurang elektronegatif kehilangan elektron dan lebih banyak atom elektronegatif yang mendapatkan elektron tersebut. Oleh karena itu, spesies yang dihasilkan justru bermuatan ion dan mereka membentuk ikatan karena daya tarik elektrostatik yang kuat.
Ikatan ionik terbentuk antara logam dan logam bukan logam. Secara umum, logam tidak memiliki banyak elektron valensi di kulit terluar; Namun, logam non-logam mendekati delapan elektron di dalam cangkang valensi. Oleh karena itu, non-logam cenderung menerima elektron untuk memenuhi aturan oktet.
Contoh senyawa ion adalah Na + + Cl - à NaCl
Sodium (logam) hanya memiliki satu elektron valensi dan Klorin (bukan logam) yang memiliki tujuh elektron valensi

Apa itu Senyawa Kovalen?
Senyawa kovalen dibentuk dengan membagi elektron di antara dua atau lebih atom untuk memenuhi "aturan oktet". Jenis ikatan ini biasa ditemukan pada senyawa non-logam, atom dari senyawa yang sama atau elemen di dekatnya dalam tabel periodik. Dua atom yang memiliki nilai elektronegatifitas yang hampir sama tidak menukar (menyumbangkan / menerima) elektron dari cangkang valensi mereka. Sebagai gantinya, mereka berbagi elektron untuk mencapai konfigurasi oktet.
Contoh senyawa kovalen adalah metana (CH 4 ), Karbon monoksida (CO), monodromida yodium (IBr)
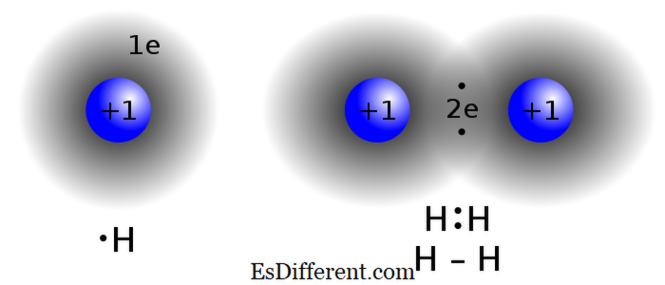
ikatan kovalen
Apa perbedaan antara ionik dan kovalen Senyawa?
Definisi Senyawa Ionik dan Senyawa Kovalen
Senyawa ionik: Senyawa ionik adalah senyawa kimia kation dan anion yang disatukan oleh ikatan ion dalam struktur kisi.
Senyawa kovalen: Senyawa kovalen adalah ikatan kimia yang dibentuk oleh pembagian satu atau lebih elektron, terutama pasang elektron, di antara atom.
Sifat Senyawa Ionik dan K Covalen
Sifat Fisik
Senyawa Ionik:
Semua senyawa ionik ada sebagai padatan pada suhu kamar. Senyawa ionik memiliki struktur kristal yang stabil. Oleh karena itu, mereka memiliki titik lebur yang lebih tinggi dan titik didih. Kekuatan tarik antara ion positif dan negatif sangat kuat.
- diff Article Middle before Table ->
Ionic Compound| Penampilan | Titik Peleburan | NaCl - Sodium klorida |
| Padatan kristal putih | 801 ° C | KCl - Kalium klorida |
| Kristal putih atau tidak berwarna | 770 ° C | MgCl |
| 2 - Magnesium klorida Padatan kristal putih atau tidak berwarna | 1412 ° C | Senyawa Kovalen: Senyawa kovalen ada dalam ketiga bentuk; sebagai zat padat, cairan dan gas pada suhu kamar. |
Titik leleh dan titik didihnya relatif rendah dibandingkan dengan senyawa ionik.
Senyawa Kovalent
Penampilan
| Titik Peleburan | HCl-Hidrogen klorida | Gas tak berwarna |
| -114. 2 ° C | CH | 4 |
| -Methane Gas tak berwarna -182 ° C | CCl | 4 |
| - Karbon tetraklorida Cairan tak berwarna -23 ° C | Konduktivitas | Senyawa Ionik: |
Senyawa ion padat tidak memiliki elektron bebas; Oleh karena itu, mereka tidak melakukan listrik dalam bentuk padat. Tapi, bila senyawa ion dilarutkan dalam air, mereka membuat larutan yang melakukan listrik. Dengan kata lain, larutan berair dari senyawa ion adalah konduktor listrik yang baik.
Senyawa Kovalen: Baik senyawa kovalen murni maupun bentuk terlarut dalam air tidak mengalirkan listrik. Oleh karena itu, senyawa kovalen adalah konduktor listrik yang buruk pada semua fase.
Kelarutan Senyawa Ionik:
Sebagian besar senyawa ionik larut dalam air, namun tidak larut dalam pelarut non-polar.
Senyawa Kovalen: Sebagian besar senyawa kovalen larut dalam pelarut non-polar, namun tidak dalam air.
Kekerasan Senyawa Ionik:
Padatan ionik adalah senyawa yang lebih keras dan rapuh.
Senyawa Kovalen: Umumnya, senyawa kovalen lebih lembut dari padatan ionik.
Image Courtesy: "Bond ikatan kovalen" oleh Jacek FH - Memiliki pekerjaan sendiri. (CC BY-SA 3. 0) melalui Commons "IonicBondingRH11" oleh Rhannosh - Memiliki pekerjaan. (CC BY-SA 3. 0) melalui Wikimedia Commons




