Perbedaan antara elemen blok S dan P | S vs P Unsur Blok
Selisih Kunci - S vs Elemen Blok P
Perbedaan antara elemen blok s dan p dapat dijelaskan dengan menggunakan konfigurasi elektronik mereka. Pada elemen blok s, elektron terakhir mengisi subkulit s dan elemen blok p, elektron terakhir mengisi subkulit p. Saat mereka membentuk ion; elemen blok menghapus elektron mereka dari subkulit terluar dengan mudah sedangkan elemen blok p menerima elektron ke p subkulit atau melepaskan elektron dari p-subkulit. Beberapa elemen dalam kelompok p membentuk ion positif yang mengeluarkan elektron dari p-subkulit terluar dan beberapa elemen (unsur yang paling elektronegatif) membentuk ion negatif yang menerima elektron dari yang lain. Bila Anda mempertimbangkan sifat kimia, ada perbedaan yang signifikan antara elemen blok s dan p; Hal ini pada dasarnya disebabkan oleh konfigurasi elektron.
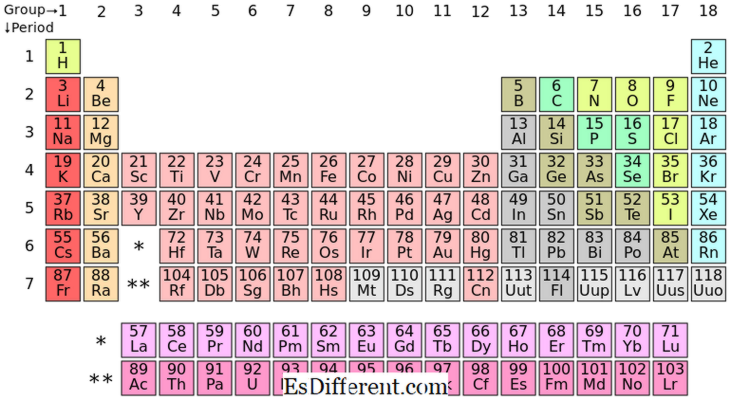
Apakah Elemen S-blok itu? Elemen blok-blok adalah unsur kimia dalam kelompok I dan kelompok II pada tabel periodik. Karena s subkulit hanya bisa menampung dua elektron, elemen ini biasanya memiliki satu elektron (kelompok I) atau dua (kelompok II) di kulit terluar. Unsur dalam kelompok I dan II ditunjukkan di atas dalam tabel.
- diff Article Middle before Table ->
IA| II A | 2 | |
| Li | Jadilah | 3 |
| Na | Mg | 4 |
| K | Ca | 5 |
| Rb | Sr | 6 |
| Cs | Ba | 7 |
| Fr | Ra | |
IA
| Logam alkali | II A |
| Logam alkali tanah | Semua unsur dalam s-block membentuk ion positif dan sangat reaktif. |
Penempatan Elemen S-blok dalam Tabel Periodik
Elemen blok-P adalah elemen yang elektron terakhirnya mengisi sub bagian bawah. Ada tiga orbital p; setiap orbital dapat menampung dua elektron, menghasilkan total enam elektron p. Oleh karena itu, elemen blok-p memiliki satu sampai enam elektron p dalam cangkang terluarnya. P-blok mengandung logam dan non-logam; Selain itu ada beberapa metaloida juga.
13
| 14 | 15 | 16 | 17 | 18 | 2 | |
| B | C | N | O | F Ne | 3 | Al |
| Si | P | S | Cl | Ar | 4 | Ga |
| Ge | Seperti | Se | Br | Kr | 5 | Dalam |
| Sn | Sb | Te | I | Xe | 6 | Tl |
| Pb Bi | Po | Pada | Rn | Apa perbedaan antara Elemen blok S dan P? | Konfigurasi Elektron Umum: | Unsur-Unsur S-blok: |
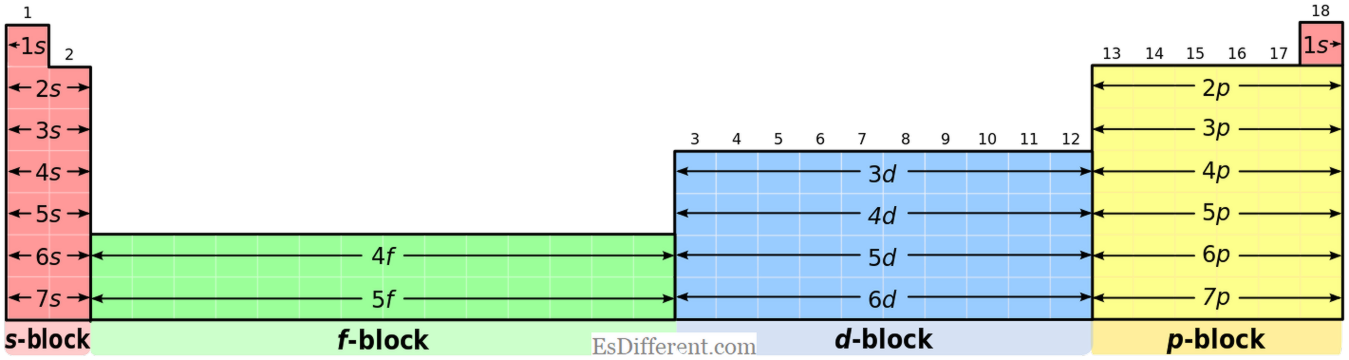
Elemen blok-S memiliki konfigurasi elektron umum dari [gas mulia] ns
1
(untuk elemen kelompok I) dan [gas mulia] ns 2 (untuk elemen kelompok II). Elemen blok-P: Elemen blok-P memiliki konfigurasi elektron umum dari [gas mulia] ns 2 np
1-6 . Tapi, helium memiliki konfigurasi 2 ; Ini adalah situasi khusus. Negara Oksidasi: Unsur S-blok: Elemen blok-S tidak menunjukkan banyak keadaan oksidasi seperti elemen blok-p. Sebagai contoh, elemen kelompok I menunjukkan negara oksidasi +1 dan elemen kelompok II menunjukkan +2 keadaan oksidasi. Elemen blok P: Tidak seperti elemen s-blok, elemen blok-p memiliki keadaan oksidasi umum untuk masing-masing kelompok dalam tabel periodik dan beberapa keadaan oksidasi tambahan lainnya bergantung pada stabilitas ion.
Kelompok
13 14
15 16




