Perbedaan antara Tekanan Parsial dan Tekanan Uap Perbedaan Antara
Tekanan parsial dan tekanan uap biasanya digunakan. istilah ilmiah yang berkaitan dengan jumlah tekanan yang diberikan oleh komponen sistem, namun identitas mereka dapat membingungkan orang lain. Ada perbedaan yang jelas antara istilah-istilah ini termasuk efek dan identitas mereka. Artikel ini akan menjelaskan lebih lanjut tentang perbedaan antara istilah-istilah ini. Ini juga akan mencakup beberapa contoh untuk demystify aplikasinya.
Mari kita mulai dengan menyoroti konsep tekanan sebelum kita dapat menyelidiki perbedaan antara uap dan tekanan parsial. Tekanan secara ilmiah didefinisikan sebagai gaya yang diterapkan per satuan luas pada suatu benda atau suatu zat. Hal ini juga dapat didefinisikan sebagai gaya yang digunakan oleh partikel bertabrakan satu sama lain dan sering diukur dengan menggunakan Pascal. Dalam kasus tabrakan partikel, persamaan gas dan teori kinetik gas digunakan untuk menghitung tekanan.
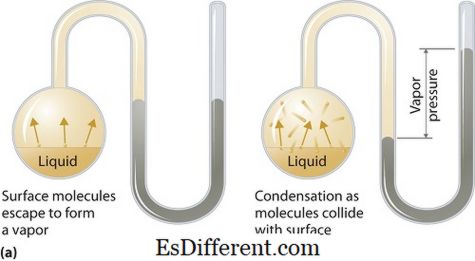
Apa itu tekanan uap?
Tekanan uap dapat diterapkan pada fase cair atau padat. Ini adalah tekanan yang diberikan oleh uap dalam kesetimbangan termodinamika pada keadaan cair atau padatnya pada suhu tertentu dalam sistem tertutup saat uap dan cairan (padat) berada dalam kontak. Tekanan ini timbul akibat penguapan, yang dimungkinkan oleh panas yang meningkat pada padatan atau cairan. Dengan demikian suhu digunakan sebagai ukuran penguapan dan berbanding lurus dengan tekanan uap. Artinya, semakin tinggi suhu semakin tinggi tekanan uapnya.
Selama penguapan, molekul udara lolos sebagai hasil dari energi kinetik yang lebih tinggi ke udara dalam sistem tertutup. Kemudian ketika dalam ekuilibrium, tekanan uap muncul antara uap dan bentuk cairnya yang dikondensasi (padat). Dalam larutan di mana kekuatan antarmolekul lebih lemah, tekanan uap cenderung lebih banyak, dan, sebaliknya, dalam larutan di mana kekuatan antarmolekul lebih kuat, tekanan uap kurang.
Tekanan uap juga bisa terjadi pada campuran ideal seperti yang dijelaskan oleh Hukum Raoult. Ini menyatakan bahwa tekanan uap parsial komponen tertentu dalam campuran cair atau padat sama dengan tekanan uap komponen tersebut dikalikan dengan fraksi molnya pada campuran tersebut pada suhu tertentu. Contoh di bawah ini akan menggambarkan hal itu.
Contoh 1.
Dengan campuran ideal 0, 5 mol. etanol dan 1. 5 mol. Metanol dengan tekanan uap 30KPa dan 52KPa, masing-masing, menentukan tekanan uap parsial dari masing-masing komponen.
Solusi:
Jumlah mol adalah 1. 5mol + 0. 5mol = 2. 0mol. Menurut Hukum Raoult, tekanan uap parsial sama dengan tekanan uap dikalikan dengan fraksi molar komponen tertentu itu.Dalam kasus ini, P metanol = 1. 5/2 * 52 = 39KPa dan P etanol = 0. 5/2 * 30 = 7. 5KPa.
Bila Anda memiliki tekanan uap sebagian dari komponen dalam campuran, Anda bisa mendapatkan tekanan uap total dengan menambahkannya bersama-sama. Dalam hal ini, 7. 5 + 39 memberikan 46. 5KPa tekanan uap total campuran larutan etanol dan metanol.
Faktor-faktor yang mempengaruhi tekanan uap
Identitas molekul
Seperti telah disebutkan di atas, jenis kekuatan molekuler menentukan jumlah tekanan uap yang akan diberikan. Jika kekuatannya lebih kuat, maka semakin sedikit tekanan uap, dan jika melemah, maka semakin banyak tekanan uap yang muncul. Karena itu, komposisi cairan atau padatan akan mempengaruhi tekanan uap. Suhu yang lebih tinggi menyebabkan tekanan uap lebih tinggi karena mengaktifkan lebih banyak energi kinetik untuk mematahkan kekuatan molekuler sehingga molekul bisa lepas dari permukaan cairan dengan cepat. Bila tekanan uap (tekanan uap jenuh) sama dengan tekanan eksternal (tekanan atmosfir) cairan akan mulai mendidih. Suhu yang lebih rendah akan berakibat pada tekanan uap rendah dan akan memakan waktu agar cairan mendidih.
Hukum Tekanan Parsial Dalton
Apakah tekanan parsial itu?

Gagasan tentang tekanan parsial pertama kali diajukan oleh ilmuwan terkenal John Dalton. Ini melahirkan Hukum Tekanan Parsial yang menyatakan bahwa tekanan total yang diberikan oleh campuran gas ideal sama dengan jumlah tekanan parsial gas individual. Katakanlah wadah tertentu diisi dengan gas Hidrogen, Nitrogen dan Oksigen, tekanan totalnya, P
TOTAL,
akan sama dengan jumlah oksigen, nitrogen dan hidrogen. Tekanan parsial gas dalam campuran tersebut dihitung dengan mengalikan tekanan total dengan fraksi molar gas individual. Singkatnya, tekanan parsial adalah tekanan yang diberikan oleh gas tertentu dalam campuran seolah-olah hanya bertindak sendiri di dalam sistem. Dengan demikian Anda mengabaikan gas lain saat menentukan tekanan parsial gas individual. Teori ini dapat diverifikasi dengan menyuntikkan, katakanlah, 0. 6atm dari O 2
dalam wadah 10. 0 L pada 230K dan kemudian menyuntikkan 0. 4atm N 2 dalam wadah yang sama dengan ukuran yang sama pada suhu yang sama, dan akhirnya menggabungkan gas untuk mengukur tekanan total; itu akan menjadi jumlah kedua gas tersebut. Ini jelas menjelaskan tekanan parsial gas individu dalam campuran gas non-reaktif. Menghitung tekanan parsial Menghitung tekanan parsial adalah angin yang mutlak karena hukum Dalton [1] menyediakan ketentuan untuk itu. Ini akan tergantung pada informasi khas yang diberikan. Jika, misalnya, tekanan total diberikan untuk campuran gas A dan B serta tekanan gas A, tekanan parsial B dapat dihitung dengan menggunakan P
TOTAL
= P A + P B . Sisanya adalah manipulasi aljabar. Tetapi dalam kasus dimana hanya tekanan total campuran yang telah diberikan, Anda dapat menggunakan fraksi molar gas B untuk menentukan tekanan parsial.Fraksi molar, dilambangkan dengan X, dapat ditemukan dengan membagi mol gas B dengan total mol campuran gas. Kemudian untuk menemukan tekanan parsial, Anda akan mengalikan fraksi molar, X, dengan tekanan total. Contoh di bawah ini menguraikannya. Contoh 2. Campuran Nitrogen dan Oksigen, dengan 2. 5 mol dan 1. 85 mol, masing-masing, disuntikkan dalam wadah 20 0L dengan tekanan total 4atm; hitung tekanan parsial yang diberikan oleh gas Oksigen.
Solusi:
Jumlah mol dalam campuran adalah 2. 5 + 1. 85 = 4. 35 mol. Jadi fraksi molar Oksigen, X
o , akan menjadi 1. 85 mol / 4. 35 mol = 0. 425 mol. Tekanan parsial Oksigen akan menjadi 0. 425 * 4atm = 1. 7atm. Tekanan parsial dari gas yang tersisa dapat dihitung mengikuti pendekatan yang sama atau dapat dihitung dengan menggunakan gas Oksigen dan tekanan total seperti yang diuraikan oleh hukum Tekanan Parston Dalton bahwa tekanan total gas non-reaktif sama dengan jumlah tekanan parsial Perbedaan antara tekanan uap dan tekanan parsial Dari penjelasan di atas, terlihat bahwa tekanan uap dan tekanan parsial adalah dua tekanan yang berbeda. Tekanan uap berlaku pada fase cair dan padat sementara tekanan parsial berlaku pada fase gas. Tekanan uap diberikan dalam transisi fasa setelah panas yang cukup ditambahkan ke larutan sehingga menyebabkan molekul-molekulnya untuk melepaskan diri dalam sistem tertutup.
Perbedaan utama antara tekanan parsial dan tekanan uap adalah tekanan parsial adalah tekanan yang diberikan oleh gas individual dalam campuran seolah-olah hanya ada di sistem itu, sedangkan tekanan uap mengacu pada tekanan yang diberikan oleh uap di dalam kesetimbangan termodinamika dengan keadaan padat atau padat. Tabel di bawah ini memberikan perbandingan singkat dari tekanan ini.
Tekanan Uap
Tekanan Parsial
| Hal ini diberikan oleh uap cair atau uap padat pada fase terkondensasi dalam kesetimbangan | Hal ini diberikan oleh gas individu dalam campuran gas yang tidak reaktif |
| Telah dijelaskan dengan baik oleh Raoult's Hukum | Baik dijelaskan oleh Hukum Dalton |
| Berlaku dalam fase padat dan cair | Berlaku hanya dalam fase gas |
| Diam-diam dengan luas permukaan atau volume sistem | Dihitung dengan menggunakan gas dalam keadaan sama. volume |
| Dihitung dengan menggunakan fraksi mol dari zat terlarut | Dihitung dengan menggunakan fraksi mol gas |
| Wrap Up! | Tekanan uap dan tekanan parsial adalah dua istilah ilmiah penting yang digunakan dalam menentukan efek gaya yang diterapkan oleh uap dan gas, masing-masing, dalam sistem tertutup yang diberikan pada suhu tertentu. Perbedaan utama mereka adalah area aplikasi dengan tekanan uap yang diaplikasikan pada fase cair atau padat, sedangkan tekanan parsial diterapkan pada gas individual dalam campuran gas ideal dalam volume tertentu. |
Tekanan parsial dihitung dengan mudah dengan mengikuti Hukum Tekanan Parsial Dalton, sedangkan tekanan uap dihitung dengan menerapkan Hukum Raoult.Dalam campuran tertentu, setiap komponen gas memberikan tekanannya sendiri, yang disebut tekanan parsial yang terlepas dari gas-gas lain. Dan bila Anda menggandakan tahi lalat dari setiap komponen dengan suhu yang tersisa konstan, Anda akan meningkatkan tekanan parsialnya. Menurut Clausius-Clapeyron hubungan [2], tekanan uap meningkat saat suhu meningkat.
Dengan informasi di atas, Anda harus bisa membedakan antara tekanan uap dan tekanan parsial. Anda juga harus bisa menghitungnya dengan menggunakan fraksi molar dan mengalikan dengan total tekanan. Kami telah memberi Anda contoh khas untuk menguraikan penerapan tekanan ini.




